Expérience 2
Expérience n°2 : Distillation des solutions obtenues
I-Introduction
Afin de connaitre la quantité d'alcool formée, nous avons décidé de procéder à la distillation de 100 mL de chacune de nos quatre solutions fermentées dans des conditions différentes.
II-Théorie
Lors d'une distillation, le but est de séparer plusieurs liquides miscibles entre eux mais ayant des températures d'ébullition différentes. Pour se faire, nous avons utilisé un montage spécifique de distillation à pression atmosphérique qui est le suivant :
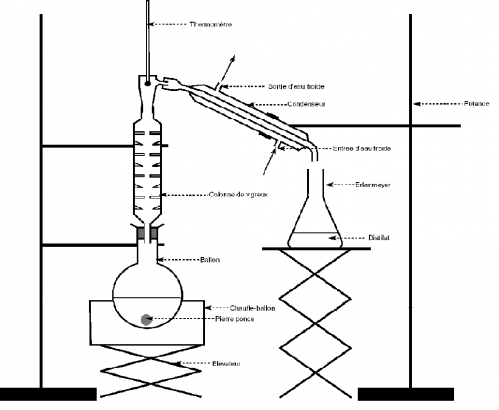
Dans notre cas, le but est de séparer l'eau (H2O) dont la température d'ébullition à la pression atmosphérique est de 100°C et l'éthanol (C2H6O) dont la température d'ébullition est de 78°C. En théorie, il suffit simplement de chauffer le mélange et d'attendre que la température monte. En présence d'un corps pur, la température se stabilise, et celui-ci s'évapore. Dans notre cas, la température devrait se stabiliser à 78°C, point d'ébullition de l'éthanol. Puis, la température réaugmentera pour stagner vers 100°C. A ce stade, il faudra retirer l'éprouvette contenant l'éthanol ainsi distillé puis en remettre une autre pour récupérer l'eau. Cependant, on ne peut pas obtenir de l'éthanol pur avec cette technique. En effet, pendant la phase où la température se maintient à 78°C, certaines molécules d'eau se lient à des molécules d'éthanol formant un azéotrope qui s'évapore à la température d'ébullition de l'éthanol.
III-Résultats des distillations
Voici ci-dessous le tableau représentant nos résultats de la distillation.
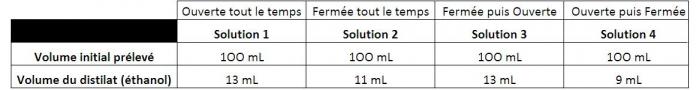
Selon nos distillations, il y a eu le plus de production d'éthanol dans la solution 1 (Ouverte tout le temps) et dans la solution 3 (Fermée puis ouverte). C'est en opposition avec nos hypothèses. En effet, nous avons pensé que dans la dernière solution (Ouverte puis fermée) la production d'éthanol allait être la plus élevée. Pourtant, la solution 4 possède selon notre distillation le moins d'éthanol des quatre solutions. Nous pouvons nous poser de nombreuses questions. En effet, dans la solution tout le temps ouverte, la production d'éthanol aurait du être quasi-nulle car les levures sont dans un milieu aérobie dans lequel les levures ne produisent pas d'éthanol. Nous pouvons donc nous demander si les distillations ont été effectués avec succès. Pour se faire, nous avons distiller une solution contenant 40% d'éthanol obtenue par dilution d'une solution d'alcool à 70%. Nous avons également fait des graphiques montrant l'évolution de la température en fonction du temps pour toutes les solutions.
IV-Exploitation des graphiques
Légende :
A) Solution 1 (ouverte)
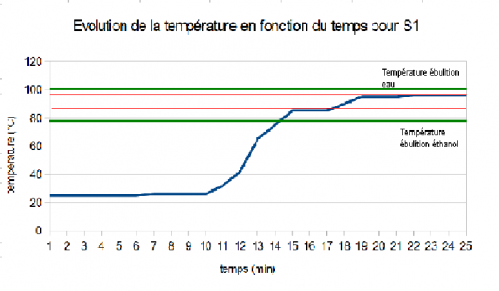
Pour cette solution, le graphique nous montre que le premier palier de stabilisation de la température se trouve à 85°C soit 8° au dessus de la température normale d'ébullition de l'éthanol (ligne verte du bas). Puis, le second palier où la température se stabilise se trouve à 4-5°C en dessous de la température d'ébulition de l'eau (ligne verte du haut). Nous pouvons en déduire que soit notre solution contient des corps pur différents de l'éthanol et de l'eau, soit que le thermomètre n'est pas fiable.
B) Solution 2 (Fermée)
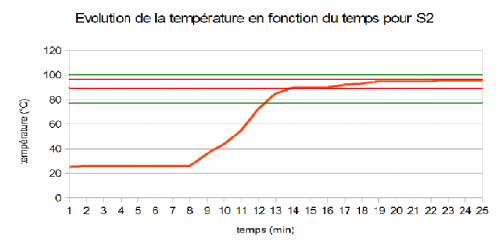
La graphique nous montrant l'évolution de la température en fonction du temps de cette solution nous permet de dire que l'on a atteint un premier palier à environ 90°C puis que l'on a atteint un second palier 3° en dessous de la température d'ébullition de l'eau soit à 97°C. Grâce à ce graphique, nous pouvons dire qu'il n'y a pas eu de palier au niveau de la température d'ébullition de l'éthanol. La présence d'éthanol dans cette solution peut etre remise en cause avec les résultats obtenus.
C) La solution 3 (fermée puis ouverte)
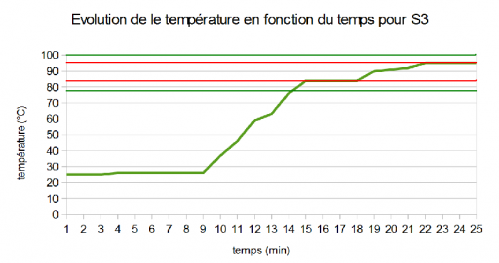
Dans ce graphique, on peut voir que le premier palier est assez proche de la température d'ébullition de l'éthanol (environ 5°C de plus). Le second palier quant à lui, se trouve 5°C en dessous de la température d'ébullition de l'eau.
D) Solution 4 (Ouverte puis fermée)
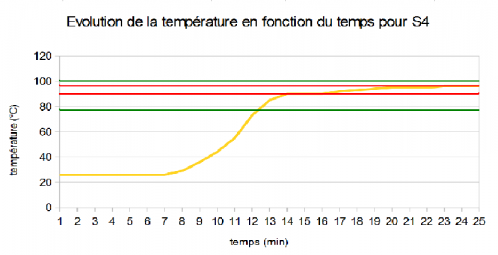
Avec ce graphique, on peut voir que le premier palier où la température se stabilise se trouve largement au-dessus de la température d'ébullition de l'éthanol (12°C au dessus). Par contre, le second palier se trouve à seulement 2°C en-dessous de la température d'ébullition de l'eau.
E) CONCUSION DES GRAPHIQUES
Selon nos graphiques, nos distillations ne nous assurent pas la présence d'éthanol. En effet, le premier palier de chaque distilation ne concorde jamais exactement avec la température d'ébullition normale de l'éthanol. Mais le plus surprenant est que le second palier ne concorde lui non plus avec la température d'ébulition de l'eau. On s'est donc posé la question de la fiabilité de la distillation. Pour vérifier cette fiabilité, nous avons donc décider d'effectuer une expérience témoin. Nous avons donc distillés 100 mL de solution contenant 40% d'éthanol.
Ci-dessous, le graphique représentant l'évolution de la température en fonction du temps pour la solution témoin.
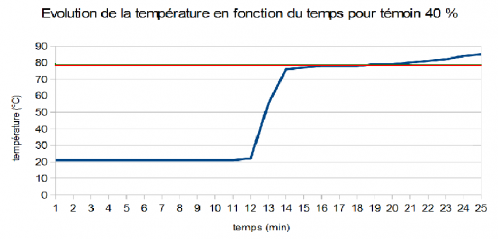
Avec ce graphique, on peut voir que le palier où la température stagne est confondu avec la température d'ébullition de l'éthanol. Cela signifie que notre montage pour effectuer la distillation est fonctionnel et que les résultats de toutes les distillations précédentes sont exacts. Nous n'avons pas le temps de continuer la distillation, de ce fait, nous n'avons pas obtenu le palier où l'eau s'évapore mais l'on peut tout de même observer une remontée de la température à la 22ème minute.
La création de ces graphiques nous a été conseillé par notre professeur et nous a permis de faire d'autres observations. Nous avons en effet constaté que la température augmentait peu pendant les 10 premières minutes puis qu'elle augmentait très rapidement pour atteindre la température d'ébullition du corps dont celle-ci est la plus basse. Ils nous ont également permis de voir si il y avait oui ou non présence d'éthanol mais pour le moment, les résultats de nos graphiques ne nous permettent pas de certifier la présence de cet alcool car nos graphiques ne montrent pas un palier où la température stagne au niveau de la température d'ébullition de l'éthanol.














Ajouter un commentaire